Der TRR erklärt
Photochemie – Licht und seine Wirkung auf die Materie
Moleküle sind die kleinsten Einheiten einer chemischen Verbindung, und man stellt sie in der Organischen Chemie üblicherweise in einer Strukturformel dar. Viele Moleküle sind in der Lage, Licht zu absorbieren und sie gehen dann chemische Reaktionen ein, die man als lichtinduzierte oder photochemische Reaktionen bezeichnet. Wer jemals einen Sonnenbrand hatte, kann bezeugen, dass der Einfluss des Lichts auf Materie nicht immer angenehm ist. Aus dem Alltag kennen wir das Phänomen, das Stoffe bleichen, wenn sie längere Zeit dem Sonnenlicht ausgesetzt sind. Auf der anderen Seite wissen wir, dass Pflanzen in der Lage sind, mit Hilfe von Sonnenlicht Kohlendioxid in Sauerstoff zu verwandeln und Energie zu speichern. Das Licht ist notwendig, um bestimmte lebensnotwendige Substanzen (z. B. Vitamin D) zu erzeugen. All diese Beobachtungen sind Folgen photochemischer Reaktionen, und in diesem kurzen Essay wollen wir Ihnen vermitteln, was dabei passiert.
Licht ist der Müsliriegel der Moleküle
Die Sprache der Naturwissenschaften ist gar nicht so weit von unserer Alltagssprache entfernt. „Wow, hat diese Person aber eine Energie“, sagen wir, wenn jemand besonders aktiv ist, oder wie oft hört man geplagte Eltern stöhnen: „Das Kind hat zu viel Energie!“. Nun es ist es nicht so, dass man Menschen gezielt Energie zuführen könnte, aber wenn wir einmal annehmen, dass die viel beworbenen Müsliriegel (oder auch Power-Riegel, Power Bars), tatsächlich dem Menschen Energie verleihen würden, dann wäre der Vergleich naheliegend, dass das Licht einem Molekül in ähnlicher Weise Energie zuführt. Wir nennen nach der Aufnahme von Energie das Molekül angeregt, oder es befindet sich in einem angeregten Zustand.
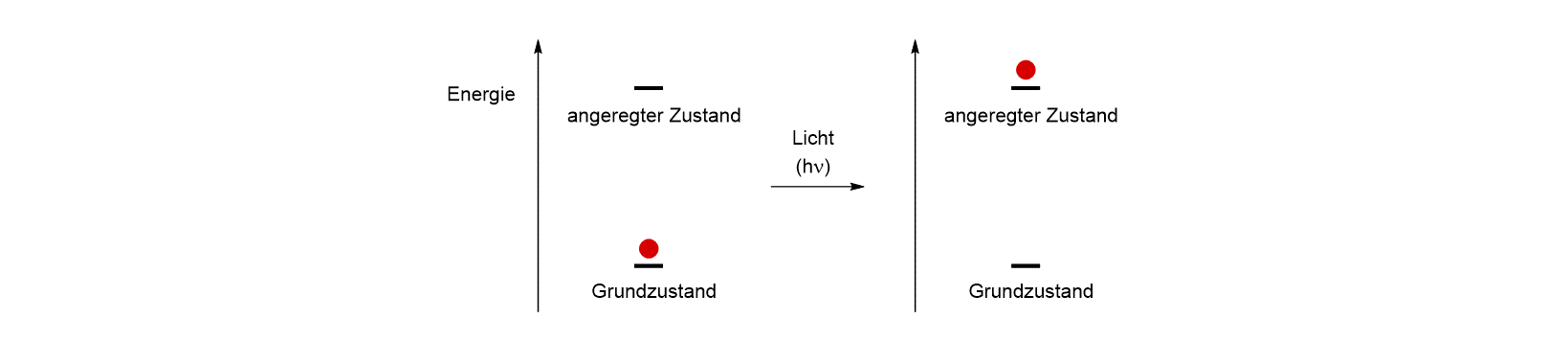
Bevor wir weiterfahren, müssen wir uns zunächst ein bisschen mit dem Licht selbst beschäftigen. Für die obige Betrachtung ist es hilfreich, wenn wir das Licht als ein Teilchen (Quant) auffassen, das auf ein Molekül prallt und dessen Energie von seiner Frequenz ν (Einheit 1/Sekunde = 1/s = s-1) abhängt. Je höher die Frequenz, umso energiereicher ist das Licht. Die Konstante h, das Planck’sche Wirkungsquantum, hat die Einheit J (Joule) x s (Sekunde). Multipliziert man also h mit der Frequenz erhält man die Einheit einer Energie (J). Die Frequenz ist der Wellenlänge λ umgekehrt proportional. Die Lichtgeschwindigkeit c (c = 3 x 108 m s-1) verknüpft die beiden Größen: c = ν x λ. Die Lichtgeschwindigkeit ist eine Konstante. Je langwelliger das Licht, desto geringer ist also seine Frequenz und seine Energie. Wir können Licht nur sehen, wenn es in einem bestimmten Wellenlängenbereich liegt. Kurzwelliges Licht ist violett, langwelliges Licht rot. Dazwischen liegen die gesamten Farben des Spektrums. Das nicht sichtbare kurzwelligere Licht, nennen wir UV-Strahlung oder UV-Licht (UV = ultraviolett), das nicht sichtbare langwellige Licht IR-Strahlung (IR = infrarot). UV-Strahlung ist vergleichsweise energiereich, IR-Strahlung energiearm. Der sichtbare Bereich des Lichts überstreicht Wellenlängen von ungefähr 400 bis 800 nm (1 nm = 10-9 m).
Die Aufnahme eines einzigen Lichtquants (Absorption) führt dazu, dass das Molekül in einen angeregten Zustand gelangt. Im Gegensatz zum Müsliriegel, den wir in beliebigen Portionen essen können, kann ein Molekül aber nur bestimmte Lichtquanten aufnehmen. Das ist eine Behauptung, die wir leicht überprüfen können, wenn wir uns in unserer Umgebung umschauen. Würden Moleküle jedwedes Licht aufnehmen (absorbieren) können, dann wäre eine Verbindung schwarz, wenn nicht, dann wäre sie weiß. Unsere Umgebung ist aber farbig, weil die Moleküle Licht bestimmter Wellenlängen absorbieren. Farben, die Ihnen bestimmt schon begegnet sind, sind zum Beispiel der Indigo, das Karmin oder das Curcumin.



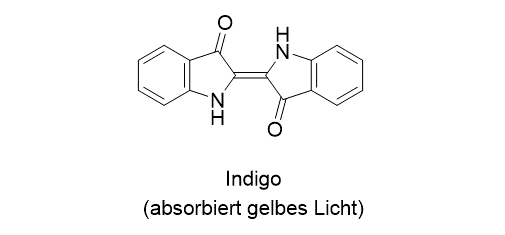
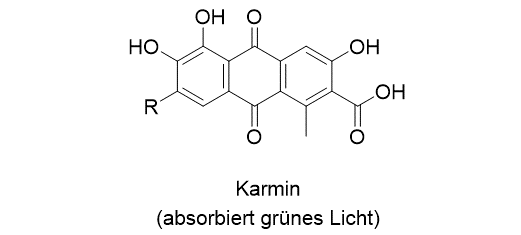
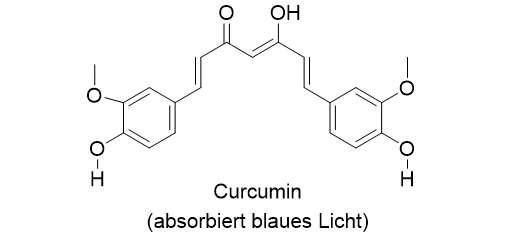
An den Beispielen erkennen Sie, wie die Farbe von der Absorptionswellenlänge abhängt. Der Indigo etwa absorbiert gelbes Licht, und der Farbstoff entnimmt dem sichtbaren Licht diese Farbe. Wir sehen die mit Indigo gefärbten Produkte in der Komplementärfarbe, also in blau. Gleiches gilt in analoger Weise für die beiden anderen gezeigten Farbstoffe (Das R in der Struktur des Karmins steht für einen Rest, der nichts mit der farbgebenden Gruppe zu tun hat). Eine Absorption im grünen Bereich, ergibt eine rote Farbe, und so weiter.
Was passiert mit dem Molekül im angeregten Zustand?
Wenn nun ein Molekül ein Lichtquant absorbiert hat, also im angeregten Zustand ist, dann bleibt es dort nicht lange, sondern es versucht, wieder zurück in den Grundzustand zu kommen. Das kann entweder so passieren, dass es in kleinen Schritten (wie auf einer Treppe) kleine Einheiten der Energie, zumeist als Wärme, abgibt. Es gibt aber auch Moleküle, die Licht ausstrahlen (emittieren), um ihre Energie loszuwerden. In der Tat existiert eine Reihe chemischer Verbindungen, die kurzwelliges Licht aufnehmen und dann langwelliges Licht emittieren. Dieses Phänomen bezeichnet man als Fluoreszenz, und die so funktionierenden Farbstoffe als Fluoreszenzfarbstoffe. Ein prominenter Fluoreszenzfarbstoff ist das Fluorescein, dessen Struktur unten abgebildet ist. Sie kennen diese Farbstoffe vermutlich von den kommerziell üblichen Textmarkern.
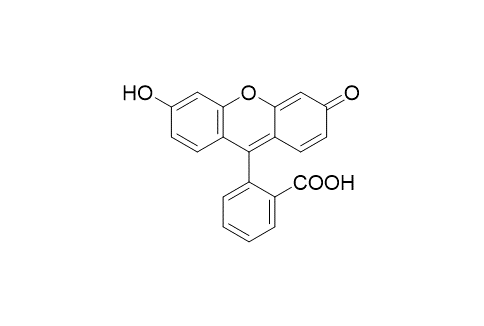

Neben der Möglichkeit, die Energie wieder abzugeben, gibt es für Moleküle auch die Möglichkeit eine chemische Reaktion einzugehen. Bei Farbstoffen ist das in der Regel nicht erwünscht, denn es bilden sich dadurch neue Verbindungen, die eine andere Farbe haben oder farblos sind. Der Farbstoff verliert dann dadurch seine Farbkraft, er bleicht.
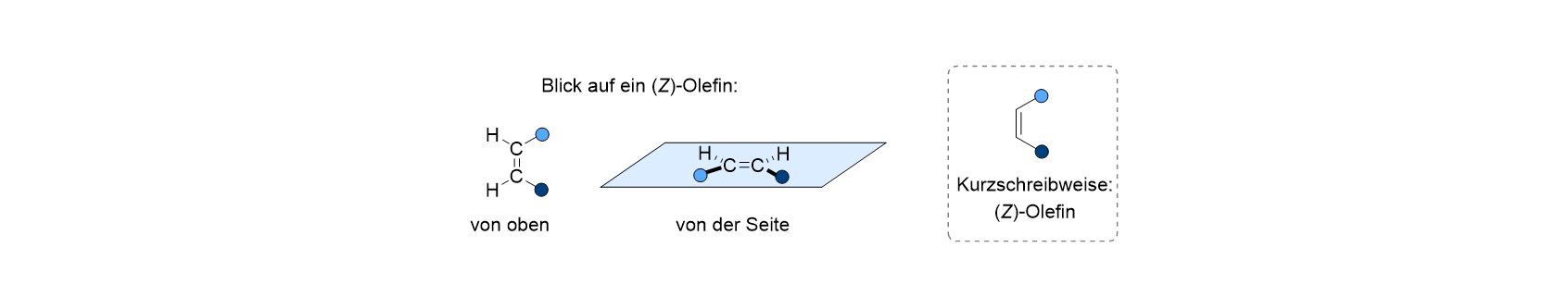
Die einfachste chemische Reaktion, die ein farbiges Molekül eingehen kann, besteht darin, ein Isomer von sich selbst zu bilden, also eine Verbindung, die dieselbe Summenformel, aber eine andere Struktur besitzt. Für die wichtigsten organischen Moleküle müssen wir dazu wissen, dass sie aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. Das Besondere am Kohlenstoff ist, dass seine Atome auch untereinander sehr starke Bindungen eingehen können, und diese Bindungen können sogar so fest sein, dass man sie als Doppelbindungen bezeichnet. Die entsprechenden Kohlenwasserstoffe mit einer Doppelbindung bezeichnet man als Olefine oder Alkene. Die Doppelbindung ist so stark, dass man um sie normalerweise keine Rotation durchführen kann, und es gibt daher von einem Olefin, das an jedem der beiden Kohlenstoffatome ein Wasserstoffatom und einen beliebigen anderen Substituenten trägt, zwei Doppelbindungsisomere. In einem der beiden Isomere sind die Substituenten „zusammen“ angeordnet, und es heißt abgekürzt das (Z)-Isomer. Ein solches (Z)-Olefin ist unten in verschiedenen Ansichten wiedergegeben, wobei die Kugeln beliebige Atomgruppen (Substituenten) sein sollen. Wichtig zu wissen ist, dass das Molekül flach ist, also alle Atome in einer Ebene liegen; das ist in der Ansicht links die Bildschirmebene, und in der Mitte die blau eingezeichnete Ebene. In der Organischen Chemie lässt man häufig vereinfacht die Kohlenstoff- und Wasserstoffatome weg, woraus die rechts gezeigte Struktur resultiert.
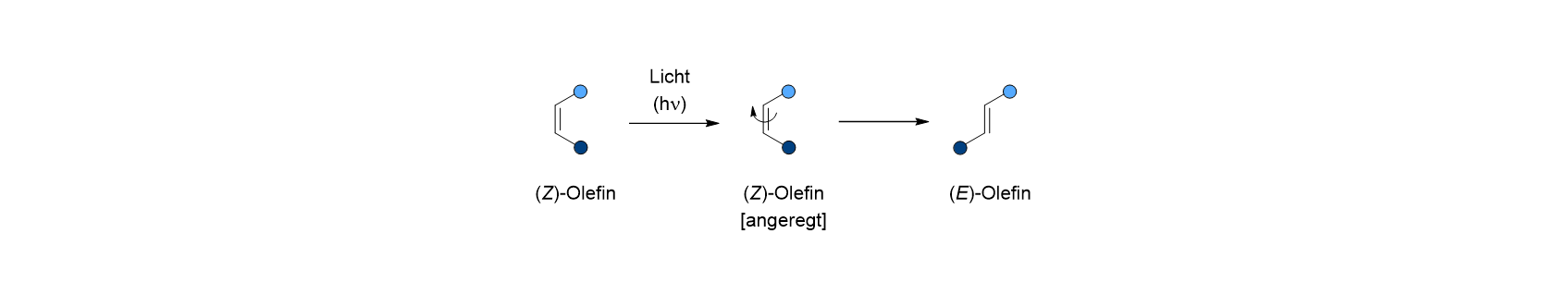
Absorbiert ein Olefin nun Licht einer geeigneten Wellenlänge, dann wird es angeregt, und es befindet sich in einem angeregten Zustand. Da in diesem Zustand die Energie so hoch ist, dass das Molekül die ansonsten starre Doppelbindung aufbrechen kann, fängt es an sich zu bewegen und damit die Energie zu verbrauchen. Ein Substituent (hier die dunkelblaue Kugel) gelangt bei dieser Drehung auf die entgegen gesetzte Seite der Bindung. Die Substituenten stehen jetzt „entgegen“ und das Isomer heißt deshalb (E)-Isomer. Auf diese Weise hat das Molekül die Energie, die es aufgenommen hat, wieder verbraucht. Aus dem (Z)-Olefin ist ein (E)-Olefin geworden.
Dieser Prozess hat weitreichende Bedeutung, denn das Molekül ändert natürlich durch eine solche Z/E-Isomerisierung ganz gewaltig seine Form. Die Natur hat diese Formänderung in genialer Weise in den Prozess implementiert, der uns erlaubt, sichtbares Licht wahrzunehmen, zu sehen. Dazu hat sie ein Enzym entwickelt, das ein 20 Kohlenstoffatome haltiges Olefin, das Retinal (Vitamin A), selektiv in ein bestimmtes (Z)-Isomer überführt. Dieses (Z)-Olefin wird über ein Stickstoffatom (N) der Aminosäure Lysin an ein Protein gebunden, dessen Struktur grob unten abgebildet ist. Durch die Natur dieses Proteins beeinflusst, gibt es drei verschieden Rezeptortypen im Auge, die in den Zapfen untergebracht sind, der Blaurezeptor, der Grünrezeptor und der Rotrezeptor. Ein weiterer Rezeptortyp findet sich in den Stäbchen, die für die Helligkeitswahrnehmung verantwortlich sind.
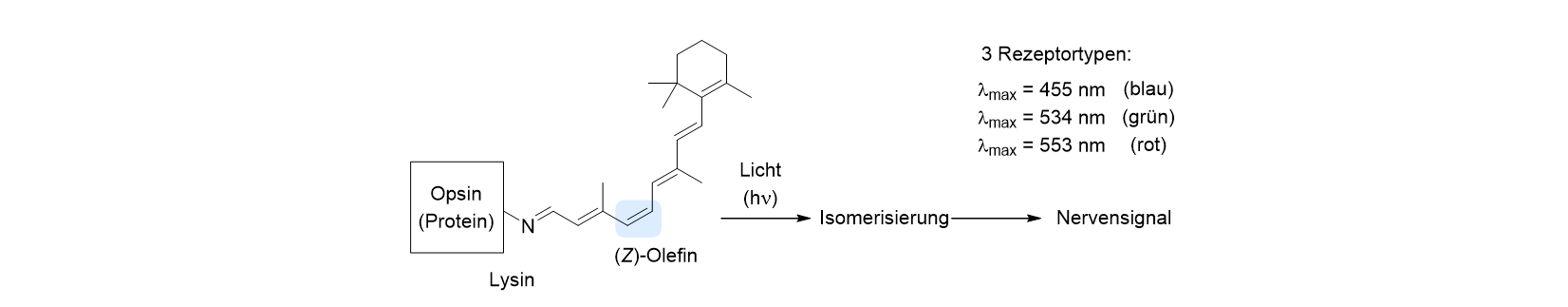
Die Rezeptoren in den Zapfen unterscheiden sich darin, dass sie Licht unterschiedlicher Wellenlänge absorbieren. Die maximale Wellenlänge λmax steht für die Wellenlänge, die am besten absorbiert wird, aber die Absorption erstreckt sich über einen größeren Bereich. Der zentrale Punkt aber ist, dass das Olefin nach der Anregung, also nach der Aufnahme des Lichts eine Z/E-Isomerisierung durchführt, die mit einer großen Änderung der Struktur einhergeht. Diese Änderung wird von der Zelle wahrgenommen und in ein Nervensignal umgewandelt, das dem Gehirn die Information über die Farbe oder die Helligkeit gibt. Das verbrauchte (E)-Olefin, das Retinal, wird im Anschluss vom Opsin gelöst und wieder (chemisch) regeneriert. Der Prozess der Z/E-Isomerisierung wird auch genutzt, um gezielt Sonnenlicht „unschädlich“ zu machen, und viele kosmetische Lichtschutzmittel enthalten Olefine, die UV-Strahlung absorbieren und durch eine Isomerisierung die Energie verbrauchen.
Reaktionen im angeregten Zustand: Photochemie und der TRR 325
Neben den im vorangegangenen Kapitel besprochenen, vergleichsweise einfachen Prozesse können angeregte Moleküle auch chemische Reaktionen eingehen. Man bezeichnet solche Reaktionen als photochemische Reaktion und die Wissenschaft, die sich damit beschäftigt, als Photochemie. Es gibt zwei wesentlich Charakteristika photochemischer Reaktionen:
(a) Photochemische Reaktionen brauchen keine zusätzliche Energiequelle außer dem Licht. Sie schonen damit in idealer Weise die auf der Erde vorhandenen Ressourcen. Eine Schlüsselreaktion des Lebens auf der Erde ist unten abgebildet. Darin wird das Treibhausgas Kohlendioxid (CO2) in einen chemischen Energieträger, das Kohlenhydrat Glucose, und in molekularen Sauerstoff (O2) verwandelt. Dieser Prozess ist thermodynamisch ungünstig: Man braucht Energie, um ihn durchzuführen. Die Natur hat es geschafft, in der Photosynthese ausschließlich das Sonnenlicht als Energiequelle zu nutzen, um Kohlenhydrate aufzubauen.
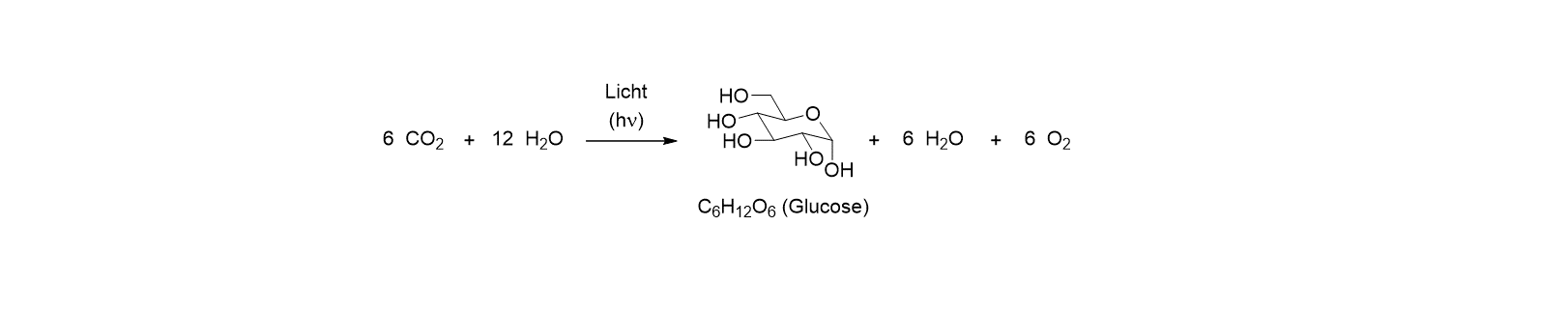
Ein großes Ziel der Photochemie, und damit auch des Transregio (TRR) 325, besteht darin, Reaktionen durch Lichtenergie möglich zu machen, für die man in einer thermischen Reaktion sehr viel Energie benötigen würde. Dazu gehört, dass man sehr stabile Bindungen spalten kann. Im vorliegenden Fall war es die Kohlenstoff-Sauerstoff-Doppelbindung (C=O) im Kohlendioxid, die gespalten wurde. Es gibt aber noch sehr viele weitere Bindungen, deren Spaltung für chemische Reaktionen wichtig ist. Dazu gehören die Bindungen des Kohlenstoffs (C) zu Wasserstoff (C-H), zu Sauerstoff (C-O) sowie zu den Halogenen Fluor (C-F) und Chlor (C-Cl), die Kohlenstoff-Kohlenstoff-Doppelbindung (C=C) in Benzol und anderen Aromaten, sowie Dreifachbindungen des Stickstoffs (N≡N) und des Kohlenstoffs (C≡C), um nur einige zu nennen. Im TRR 325 bearbeiten wir solche Reaktionen an starken Bindungen, indem wir Moleküle konstruieren, die das Licht sammeln und gemeinsam mit dem Substrat (das ist die Substanz, die die Reaktion eingehen soll) in einem Molekülverband (engl. assembly) gezielte Reaktionen ermöglichen. Konzeptionell ist die Natur hier das große Vorbild, denn sie arrondiert in der Photosynthese eine Vielzahl von katalytisch aktiven Einheiten so, dass die Produktbildung mit optimaler Effizienz verläuft.
(b) Photochemische Reaktionen ermöglichen den Zugang zu Molekülen, die man mit normalen Methoden nicht oder nur sehr umständlich herstellen kann. Dabei ist in der Regel zu beobachten, dass die Produkte sehr viel komplexer sind als die Substrate. Auch wenn man keine chemische Vorbildung hat, kann man gut erkennen, dass die links stehenden Moleküle (die Substrate) einfacher aussehen als die Moleküle rechts des Reaktionspfeils (die Produkte). Beide Beispiele, die aus der Literatur stammen (oben: J. Am. Chem. Soc. 1997, 119, 1129; unten: Angew. Chem. Int. Ed. 2020, 59, 5656), sind sogenannte Kaskadenreaktionen, bei denen nicht nur eine, sondern gleich mehrere Bindungen geknüpft werden. Mögliche zusätzliche Katalysatoren sind nicht eingezeichnet.
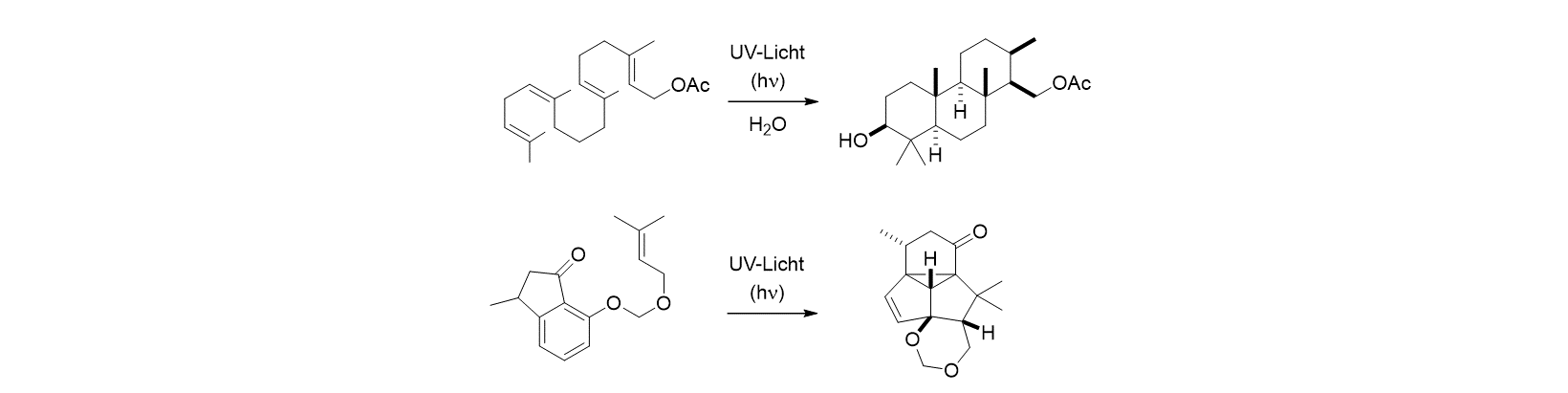
Für den TRR 325 ist im Zusammenhang mit der Effizienz und der Selektivität einer Reaktion erneut die Bildung von Molekülverbänden der Schlüssel zum Erfolg. In den oben gezeigten Fällen stellt sich die Frage, ob man nicht in einer geeigneten Umgebung und mit einem lichtsammelnden Katalysator die Reaktionen mit Sonnenlicht anstelle mit dem aktuell genutzten kurzwelligen UV-Licht (λ = 250-350 nm) durchführen könnte. Ganz generell bewegen uns Fragen wie etwa: Kann man in Molekülverbänden neue Reaktionskanäle eröffnen? Wie kann man die Ausbeuten einer bekannten photochemischen Reaktion verbessern? Kann man gezielt bestimmte Positionen in einem Molekül adressieren?
Eine weitere Frage stellt sich in Zusammenhang mit photochemischen Reaktionen, in denen Moleküle entstehen, die chiral sind (⇒ Chiralität), die sich also wie Bild und Spiegelbild verhalten. Im unten gezeigten Beispiel entsteht in der photochemischen Addition des Trifluormethansulfonylchlorids (S = Schwefel) an eine Doppelbindung ein Produkt, das in zwei spiegelbildlichen (enantiomeren) Formen vorkommt.
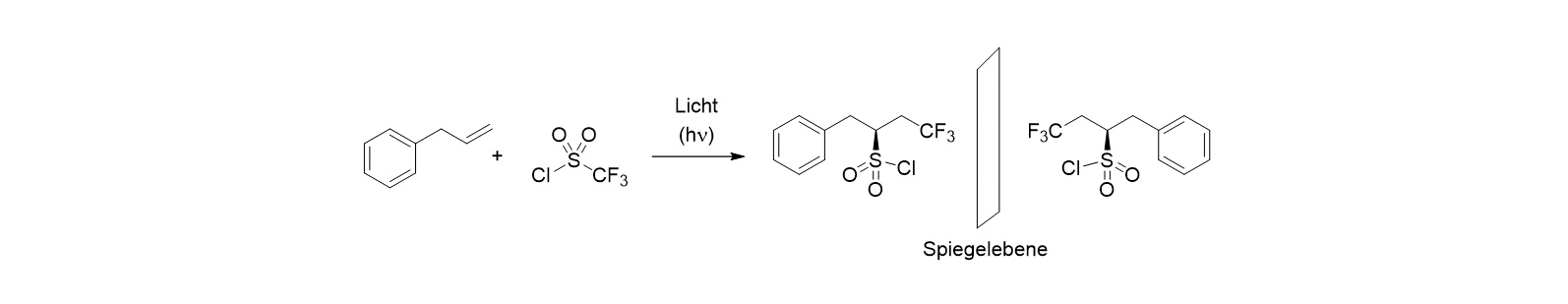
Eine zentrale Frage ist hier, wie man durch einen Molekülverband die Bildung eines der beiden enantiomeren Produkte gezielt erreichen kann.
Wie so oft bei der Grundlagenforschung ist die Frage, wozu man sie braucht, nicht direkt zu beantworten. Es ist aber aus diesem knappen Essay hoffentlich deutlich geworden, dass unsere Forschung helfen soll, chemische Prozesse, die zu wichtigen Produkten (Arzneimittel, Vitamine, Feinchemikalien, etc. ) führen, effizienter und ressourcenschonender zu machen. Unsere Forschung soll überdies neue Wege aufzeigen, wie man mit Sonnenlicht als Energiequelle – auch in größerem Maßstab – aus leicht erhältlichen, aber schwer zu aktivierenden Substanzen (Kohlenwasserstoffen, Aromaten, Kohlendioxid, Stickstoff, etc.) wertvolle Folgeprodukte gewinnen kann.






