Der TRR erklärt
Chiralität – eine zentrale Eigenschaft der Materie
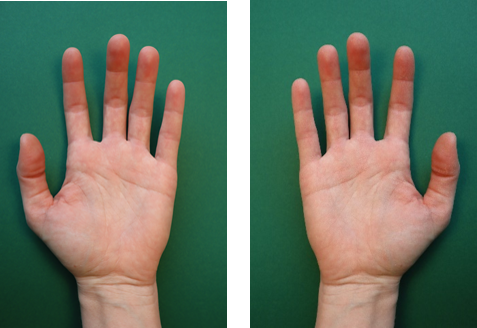
Kaum ein wissenschaftliches Phänomen ist uns vertrauter als die Chiralität. Jeder, der schon einmal versehentlich versucht hat, den Schuh am falschen Fuß oder den Handschuh an der falschen Hand anzuziehen, kann bestätigen, dass der rechte Fuß nicht in den linken Schuh und der rechte Handschuh nicht auf die linke Hand passt. Dabei ähneln sich doch einige Körperteile in der Tat sehr, lassen sich aber nicht zur Deckung bringen und verhalten sich wie Bild und Spiegelbild. Bereits der große Philosoph Immanuel Kant stellte trefflicher Weise fest: „Was kann wohl meiner Hand oder meinem Ohr ähnlicher, und in allen Stücken gleicher sein, als ihr Bild im Spiegel? Und dennoch kann ich eine solche Hand, als im Spiegel gesehen wird, nicht an die Stelle ihres Urbildes setzen…” (Prolegomena zu einer jeden künftigen Metaphysik die als Wissenschaft wird auftreten können, J. F. Hartknoch, Riga, 1783).
Von Lord Kelvin stammt zu diesem Phänomen der Begriff, den wir in der Wissenschaft dafür heute verwenden. Er definierte die Chiralität so: „I call any geometrical figure or group of points, chiral, and say that it has chirality, if its image in a plane mirror, ideally realized, cannot be brought to coincide with itself.” Auf Deutsch: „Ich nenne eine geometrische Figur oder eine Gruppe von Punkten chiral und sage, dass sie Chiralität besitzt, wenn ihr Spiegelbild in einem flachen Spiegel, ideal realisiert, nicht dazu gebracht werden kann mit ihr übereinzustimmen.“ (Baltimore Lectures 1884, C.J. Clay & Sons, London 1904). Der Begriff, den er dafür wählt, stammt aus dem Griechischen und leitet sich von dem Wort für „Hand“ ab.
Wenn Sie mit offenen Augen durch den Alltag gehen, werden Sie viele Dinge entdecken, die als Bild und Spiegelbild vorkommen. Schneckenhäuser sind ebenso chiral wie die Ringelschwänzchen von kleinen Ferkeln oder gedrehte Säulen, die man z.B. in Kirchen findet. Pflanzen wachsen in einer rechtsgängigen oder linksgängigen Schraube. Eine schöne Kollektion von Bildern zu diesem Thema findet man unter http://www.chemie.uni-regensburg.de/Anorganische_Chemie/Brunner/gal.htm (aufgerufen am 7.2.2022). Apropos Schrauben: Dort hat man sich darauf geeinigt, nur eine Art der Chiralität zu verwenden, und das Rechtsgewinde ist die vorherrschende Gewindeform. Wenn das nicht so wäre, dann könnten wir 50% der Schrauben nicht verwenden….

© by CRC 325
Chirale Moleküle
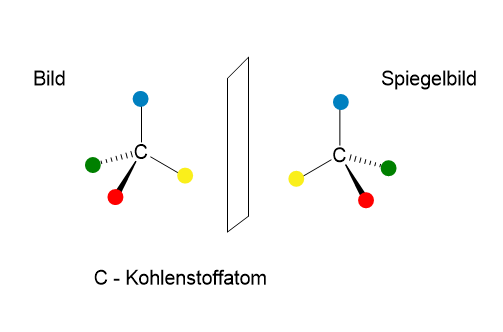
In der Chemie spielt die Chiralität deshalb eine große Rolle, weil auch Moleküle chiral sein können. Moleküle sind die kleinsten Einheiten einer chemischen Verbindung und bestehen aus Atomen. In der Organischen Chemie ist der Kohlenstoff das wichtigste Element, und ein Kohlenstoffatom bindet im Allgemeinen vier andere Atome oder Atomgruppen so, dass sie ihn tetraedrisch umgeben. Wenn man nun vier verschiedene Substituenten (in der Abbildung als farbige Kugeln gezeigt) an einem Kohlenstoffatom anbringt, dann resultiert daraus eine Struktur, für die es ein Bild und ein Spiegelbild gibt. Moleküle, die sich wie Bild und Spiegelbild verhalten, nennt man Enantiomere. Ein 50/50-Gemisch zweier Enantiomere ist ein Racemat. Das zentrale Elementatom mit den vier verschiedenen Substituenten, in diesem Fall das Kohlenstoffatom, nennt man ein stereogenes Zentrum (Chiralitätszentrum).
Viele Moleküle, aus denen unser Körper besteht, sind chiral. Dazu gehören etwa die Aminosäuren, aus denen die Enzyme aufgebaut sind, oder auch Zuckermoleküle, die eingebunden in die DNA (Desoxyribonukleinsäure) Teile unseres Erbguts ausmachen. Unten beispielhaft abgebildet ist die einfachste chirale Aminosäure, das Alanin. Am Aufbau dieses Moleküls sind noch die Atome Stickstoff (N), Sauerstoff (O) und Wasserstoff (H) beteiligt. Um die beiden Enantiomere unterscheiden zu können, gibt man ihnen eine Vorsilbe und zwar (R) oder (S), wobei wir uns an dieser Stelle nicht näher mit der Nomenklatur beschäftigen wollen. Interessanterweise hat die Natur sich entschieden, von den wichtigsten organischen Verbindungen nicht etwa ein Racemat zu verwenden, sondern nur eines der beiden möglichen Enantiomeren. Die Aminosäuren etwa kommen in unserem Körper nahezu ausschließlich als (S)-Enantiomere vor.
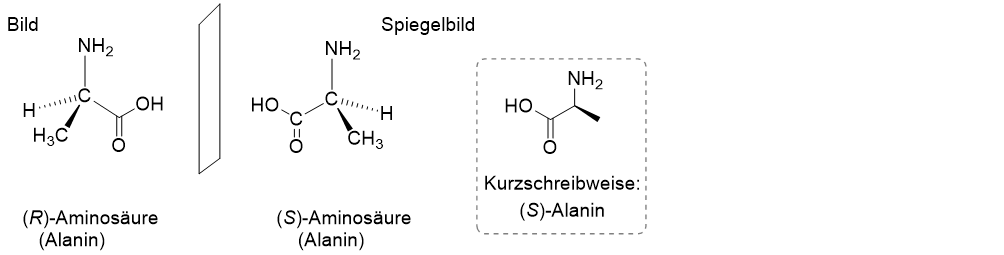
Üblicherweise wird in der Organischen Chemie die Kohlenstoffatome und die an ihnen befindlichen Wasserstoffatome nicht ausgeschrieben. Sie sehen oben auf der rechten Seite exemplarisch die Kurzschreibweise für das (S)-Alanin.
Warum es wichtig ist, dass wir chirale Moleküle selektiv herstellen können
Die Tatsache, dass unser Körper chiral ist, hat eine weitreichende Bedeutung, die im wahrsten Sinne des Wortes lebenswichtig sein kann. Genauso, wie unsere linke Hand nicht in einen rechten Handschuh passt, interagiert auch ein chirales Molekül mit unserem Körper auf spezifische Weise. Ein Enantiomer bindet an einem bestimmten Rezeptor, sein Spiegelbild vielleicht gar nicht oder an einem ganz anderen Rezeptor. Spielerisch können wir diesen Unterschied tatsächlich erschnüffeln. Carvon beispielsweise hat einen unterschiedlichen Geruch. Das eine Enantiomer riecht nach Pfefferminze, das andere Enantiomer nach Kümmel.

Ein weiteres Beispiel für ein chirales Molekül, das unterschiedliche Geruchseindrücke hinterlässt, ist das Limonen. Hier riecht das eine Enantiomer nach Zitrone, das andere Enantiomer nach Orange.
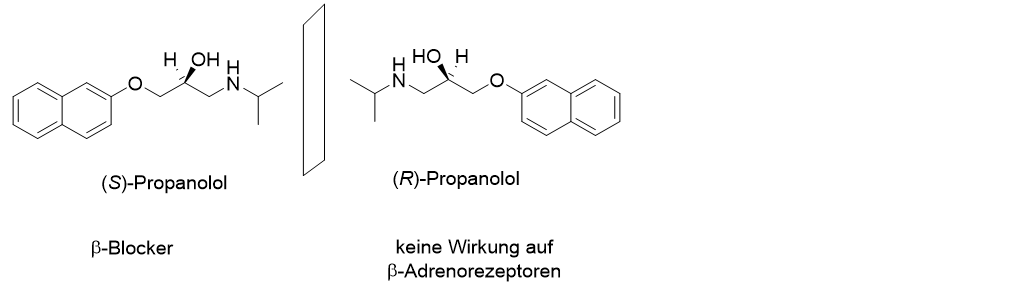
Nun ist der Geruchsinn sehr wichtig, aber man könnte meinen, dass die unterschiedlichen Eigenschaften chiraler Moleküle nur eine Spielerei ist. Dem ist jedoch nicht so! Denken Sie daran, dass wir chemische Verbindungen nicht nur per Geruch wahrnehmen, sondern dass wir sie gezielt einnehmen, um Krankheiten einzudämmen oder zu heilen. Auch in diesem Fall gilt, dass Enantiomere unterschiedliche Eigenschaften haben können (aber nicht müssen). Ein Beispiel ist der sehr häufig verordnete b-Blocker Propanolol. Der Name b-Blocker kommt daher, dass das Molekül an einem sogenannten (chiralen!) b-Adrenorezeptor angreift, was dazu führt, dass die Ruhefrequenz des Herzens und der Blutdruck gesenkt werden. Die Wirkung wird aber ausschließlich vom (S)-Enantiomer ausgeübt und nicht von seinem Spiegelbild (für eine fachliche Diskussion, allerdings in englischer Sprache, siehe z.B. Chirality 2020, 32, 722). Dass in der Regel doch das preiswertere Racemat verordnet wird, liegt daran, dass das (R)-Enantiomer keine negative Wirkung besitzt.
Die Situation ändert sich jedoch, wenn ein Enantiomer zu erheblichen gesundheitlichen Beeinträchtigungen führt und gleichzeitig unwirksam ist. So wirkt das Ethambutol in einer definierten spiegelbildlichen Form gegen Tuberkulose-Bakterien, ist also ein Antibiotikum (J. Am. Chem. Soc. 1961, 83, 2212). Allerdings ist es in höheren Dosen giftig. Sein Enantiomer ist inaktiv, hat aber dieselbe Toxizität, weshalb man hier auf die Gabe dieses Enantiomers verzichtet. Dass hier zwei Buchstaben vor dem Molekülnamen stehen, also (R,R) oder (S,S), liegt daran, dass das Moleküls zwei stereogene Zentren besitzt.
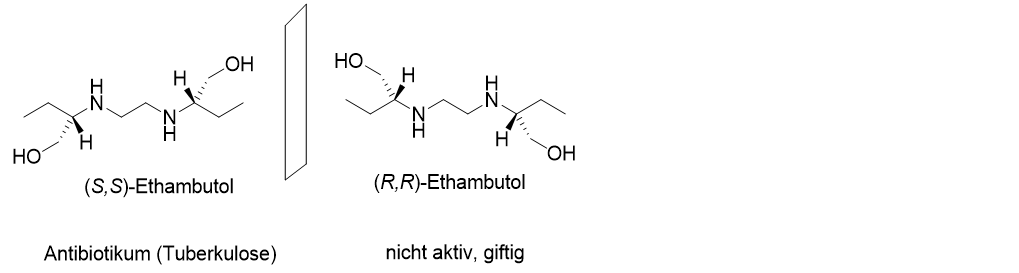
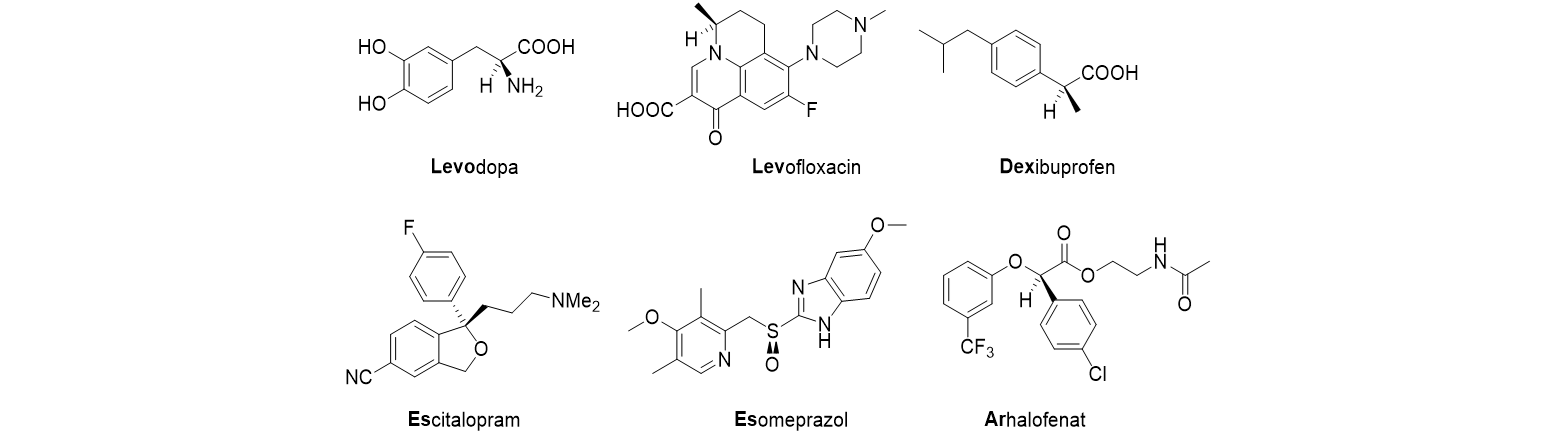
Vor dem geschilderten Hintergrund ist es klar, dass es in jedem Fall notwendig ist, beide Enantiomere eines Wirkstoffes zur Verfügung zu haben und sie bezüglich ihrer biologischen Aktivität zu testen. Danach kann man entscheiden, ob es sinnvoll ist, das Präparat enantiomerenrein einzusetzen oder nicht. Unten abgebildet sehen sie eine Auswahl von Arzneimitteln die als einzelnes Enantiomer in den Handel kommen. Häufig steckt dann im Namen ein „R“ (englisch „Ar“) oder ein „S“ („Es“), mitunter auch ein „Levo“ oder ein „Dextro“. Im letzteren Fall kommen die Namen daher, dass ein Enantiomer einer Verbindung linear polarisiertes Licht nach rechts („dextro“ abgekürzt „dex“), das andere Enantiomer das linear polarisierte Licht um denselben Betrag in die andere Richtung, also nach links („levo“), dreht. Sie kennen die Bezeichnung vielleicht von der Glucose, dem natürlich vorkommenden Traubenzucker. Dessen natürlich vorkommendes Enantiomer ist rechtsdrehend und wird daher auch als Dextrose bezeichnet.
Enantioselektive (Asymmetrische) Katalyse
Der beste Weg, enantiomere Verbindungen herzustellen, besteht darin, einen chiralen Katalysator zu verwenden. Man bezeichnet die Technik als enantioselektive oder asymmetrische Katalyse. Katalysatoren sind Substanzen, die man nur in kleinen Mengen einsetzen muss, um eine Reaktion zu beschleunigen. Wenn man also eine große Menge einer chiralen Verbindung enantioselektiv herstellen kann, dann gibt der chirale Katalysator aufgrund seiner eigenen Chiralität vor, welches Enantiomer gebildet wird. Beispielhaft gezeigt ist unten die Addition von Wasserstoff (H2) an eine nicht chirale (achirale) Verbindung. Die Abkürzung Me und Ac stehen für chemische Gruppen (Me = Methyl, Ac = Acetyl). Hierzu verwendet man einen Rhodium-Katalysator (Rh = Rhodium) in Kombination mit einer Phosphorverbindung, die chiral ist und die CAMP heißt. Hier ist das Phosphoratom das stereogene Zentrum. Das Lösungsmittel ist Isopropanol, und Dp bedeutet, dass man unter Wasserstoffdruck arbeitet. Der chirale Katalysator bewirkt nun, dass bei der Hydrierung nur das gezeigte Enantiomer und nicht dessen Spiegelbild entsteht und zwar in quantitativer (quant.) Ausbeute. Wenn Sie nach oben schauen und die Struktur des Levodopa mit dem Produkt der Hydrierung vergleichen, verstehen Sie, warum man an dieser Reaktion besonders interessiert war.
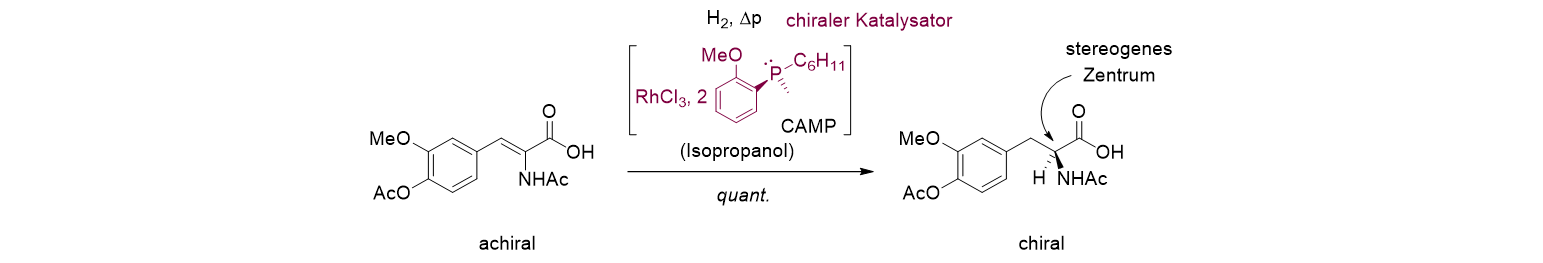
Die Entwicklung der asymmetrischen Katalyse hat ihre Ursprünge schon früh im 20. Jahrhundert, aber erst in den 1970er und 1980er Jahren kamen wichtige Übergangsmetall-katalysierte Verfahren auf, so wie die oben erwähnte Hydrierung, die von William S. Knowles und Mitarbeitern 1972 veröffentlicht wurde (Chem. Commun. 1972, 10). Für Beiträge zur asymmetrischen Übergangsmetallkatalyse erhielt Knowles zusammen mit K. B. Sharpless und R. Noyori im Jahr 2001 den Nobelpreis für Chemie. Die Information der Nobelstiftung zu diesem Preis finden Sie unter: https://www.nobelprize.org/prizes/chemistry/2001/9083-pressemitteilung-der-nobelpreis-in-chemie-2001/ (aufgerufen am 7.2.2022). Nicht nur Übergangsmetalle, sondern auch einfache Kohlenstoffverbindungen können als Katalysatoren in der enantioselektiven Katalyse fungieren. Diese Erkenntnis wurde sehr wesentlich durch die Arbeiten von B. List und D. W. C. MacMillan bestimmt, die ein Gebiet prägten, das man als (asymmetrische) Organokatalyse bezeichnet. Der Nobelpreis für Chemie des Jahres 2021 honoriert diese bahnbrechenden Ergebnisse. Informationen hierzu gibt es zum Beispiel unter: https://www.deutschlandfunk.de/chemie-nobelpreis-2021-benjamin-list-und-david-macmillan-100.html (aufgerufen am 7.2.2022).
Enantioselektive Katalyse und der TRR 325
Während die oben erwähnten Katalyseverfahren neben dem chiralen Katalysator außer Wärme (thermische Reaktionen) keine weitere Aktivierung benötigen, gibt es eine wachsende Zahl chemischer Reaktionen, die nur ablaufen, wenn man die Substrate/Ausgangsverbindungen mit Licht bestrahlt. Man nennt solche Reaktionen photochemische Reaktionen und deren Katalyse Photokatalyse. Das hört sich zunächst nach einer unnötigen Komplikation an, ist aber essentiell, um bestimmte chirale Moleküle zu synthetisieren. Es gibt – und das ist der zentrale Punkt – eine zunehmende Zahl von Molekülen, die sich nur durch Lichtbestrahlung herstellen lassen und die biologisch wichtig sind, z.B. als Medikamente. Ein zweiter Punkt bei dem die Photochemie eine zentrale Rolle spielt ist die Frage, wie man ein Racemat gezielt in ein Enantiomer überführen kann. Hier ist es thermisch nur möglich, das Racemat, das ja ein 1/1-Gemisch der beiden Enantiomeren ist, zu trennen und damit 50% des einen Enantiomers und 50% des anderen Enantiomers zu bekommen. Photokatalytische Verfahren erlauben es, gezielt aus einem Racemat nur ein Enantiomer herzustellen, also 100% des gewünschten Enantiomers zu erhalten (Deracemisierung). Das ist insofern wichtig, als sehr häufig die Bildung eines Racemats sehr viel einfacher gelingt als die selektive Herstellung eines Enantiomers durch asymmetrische Katalyse. Wenn man dann in einem nachgelagerten Schritt, aus dem Racemat gezielt ein Enantiomer herstellen kann, dann ist das nicht nur elegant, sondern auch ökonomisch.






